Свойства веществ немолекулярного строения: кристаллические решетки
Еще с основ школьной химии 8 класса все знают, что вещества можно разделить на две большие группы — это вещества молекулярного строения и вещества немолекулярного строения. Свойства их разнообразны, ведь они в значительной степени зависят от их строения и типа связей между отдельными элементами.
Оглавление:
Строение вещества
Все, что нас окружает, состоит из разнообразных химических элементов, формирующих определенные структуры при помощи чрезвычайно прочных химических связей. От этой структуры зависят форма тела, его размеры, способность реагировать с другими веществами и многое другое.
Молекула — это небольшая группа атомов, из которых состоит то или иное вещество. Например, Н (водород) — это атом, а H2O — молекула воды. Из них и состоит жидкость. Они свободно перемещаются по всему объему, то сталкиваясь, то совсем вылетая из общей массы (испарение).
Атомы — еще более мелкие элементы, чем молекулы. Внутри них есть положительно заряженное ядро, в котором плотно прижаты друг к другу нейтроны и протоны, и вращающиеся вокруг этого ядра отрицательно заряженные электроны. Из атомов и состоят структуры немолекулярного строения. Соединяются они между собой при помощи сильного электромагнитного взаимодействия, однако если атомы слишком сильно приблизятся друг к другу, то два отрицательно заряженных ядра будут отталкиваться друг от друга.
Виды кристаллических решеток
Если атомное строение подразумевает состав из множества одинаковых молекул, то у этих веществ такого набора нет. Они могут состоять, например, из отдельных атомов, из ионов или ионных соединений. Вот несколько примеров элементов, формирующих кристаллические соединения:
- Алмаз (полностью состоит из атомов углерода С)
- Кремний (Si)
- Металлы (например, железо Fe, медь Cu или золото Au)
И к соединениям, в основе которых лежат ионные связи, относятся:
- Любые соли (NaCl — хлорид натрия, K2SO4)
- Гидриды (вещества, состоящие из иона металла и водорода, например, LiH)
- Оксиды (CaO, NaO)
При нормальных условиях соединения немолекулярного строения находятся в твердом агрегатном состоянии. Атомы расположены в строгом порядке, согласно кристаллической решетке. Сами решетки бывают всего трех вариантов: металлические (в металлах), атомные (в неметаллах) и ионные (в соединениях).
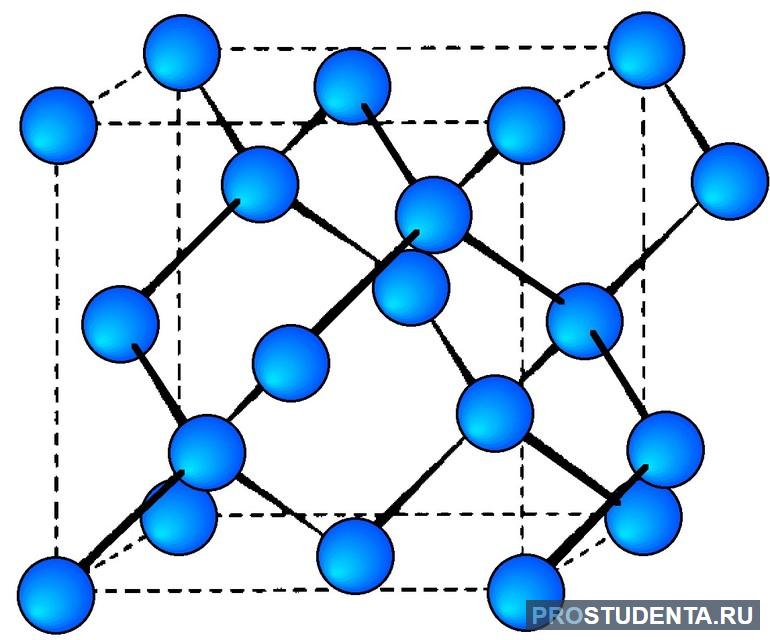
Атомные: единичные атомы
В углах таких решеток расположены единичные атомы. Они связаны друг с другом ковалентными связями. Самым простым примером вещества с такой решеткой является алмаз. Он целиком состоит из атомов углерода, формирующих кубы. Внутри этих кубов расположено еще по 4 атома, являющихся вершинами углов соседних кубов. Таким образом атомы располагаются очень плотно по отношению друг к другу, из-за чего практически не могут двигаться. Из-за этого камень становится невероятно прочным и плотным. А также благодаря этому алмазы практически не растворяются и отличаются крайне высокой температурой плавления — 3500С.
Уголь и графит тоже состоят из одного только углерода, но они совершенно не похожи на алмаз. Это как раз обусловлено возможностью углерода создавать разные атомные решетки.
После огранки алмазы превращаются в одни из самых дорогих украшений — бриллианты. А также свойствам этого материала находят применение и в промышленности, покрывая инструменты или используя для огранки и обработки менее твердых веществ.
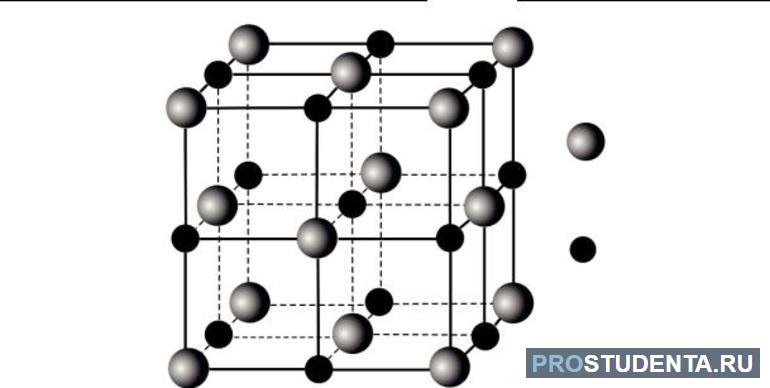
Металлические: свободные электроны
В составе металлов совершенно другие решетки. Они состоят из множества атомов и ионов, между которыми свободно перемещаются электроны. Иногда они врезаются в ионы, превращая их в атомы, а атомы, в свою очередь, могут отдавать электроны со своих внешних орбит. Благодаря такой особенности строения каждый металл может проводить электрический ток и тепло. Становятся возможными такие, казалось бы, обычные свойства, как непрозрачность, блеск, ковкость.
Металлическая решетка чем-то похожа на атомную, но их свойства существенно различаются. Именно свободные электроны отличают строение металлов от неметаллов, так как обуславливают большинство металлических свойств веществ. Даже тип связи в металлических решетках так и называется — металлическая связь.
Строение металлической решетки не изменяется, даже если объединить два разных металла, сплавив их.
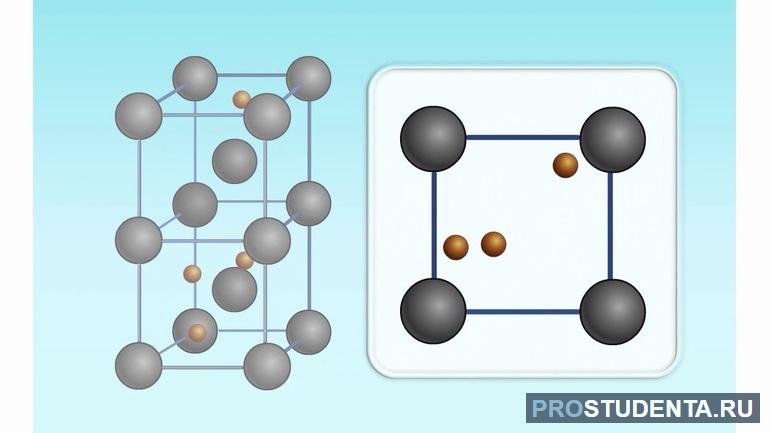
Ионные: заряженные ионы
В повседневной жизни встречается много веществ, в основе которых лежит ионная кристаллическая решетка. Примеры: поваренная соль, селитра, шпат. Ионные решетки состоят из четкой последовательности положительно и отрицательно заряженных ионов. Между ними возникают прочные ионные связи. Ионы бывают двух видов: простые (Na^+, Cl^-) и сложные (SiO4 2 -), Такие решетки встречаются в многочисленных оксидах (SiO2), солях (NaCl), гидроксидах (NaOH). Ионы натрия и хлора образуют правильные кубы, из которых и состоят кристаллы соли.
И хоть многие вещества с ионной кристаллической решеткой имеют довольно высокую температуру кипения, в воде и кислотах, например, H2SO4 (серная кислота), они растворяются достаточно хорошо.
Различия в строении часто влекут за собой и различия в химических и физических свойствах, так как и те, и другие напрямую зависят от типа формирования связей в кристаллах. Немолекулярное строение могут иметь не только простые элементы, но и более сложные соединения. Именно это многообразие соединений и дает людям возможность постоянно экспериментировать и использовать какие-либо свойства элементов в собственных целях.


Ещё никто не комментировал эту статью. Оставьте комментарий первым!