Физический смысл электролиза и закон Фарадея
В 1836 году Майкл Фарадей экспериментально открыл возможность протекания тока через жидкость. Количественное описание процесса получило название законы Фарадея для электролиза. Учёным было выяснено две закономерности. Опыты физика внесли значительный вклад в последующие исследования свойств жидких материалов став одной из первых ступенек в понимании физических и химических процессов связанных сними.
Оглавление:
Общие сведения
При пропускании электрического тока через раствор происходит физико-химический процесс, названный электролизом. Заключается он в способности выделения веществами вторичных продуктов. Термин произошёл от греческого λυσις, что в переводе обозначает «разрушение». Его понятие довольно точно описывает происходящий процесс.
Любое вещество состоит из совокупности связных атомов и молекул, которые образуют ионы при потере или присоединении электронов. Когда их количество превышает число протонов заряженная частица становится отрицательной. Называют её катионом. Если же ион потерял электрон, то он становится положительно заряженным. В этом случае его называют анионом.
Чтобы связи в веществе нарушились, тем самым электрически нейтральный ион получил знак, нужно выполнить какое-либо воздействие. Для жидкости это и есть электролиз — разделение частиц под действием электрического тока. Но при этом элементы обладают способностью диссоциировать. Другими словами, распадаться при смешивании на два или более молекулярных элемента. В 1887 году учёный Сванте Аррениус смог сформулировать теорию о диссоциации. Она в дальнейшем была дополнена положением о гидратации.
В результате ряда экспериментов все жидкие вещества были разделены на два вида:
- Электролиты — элементы проводящие электрический ток. К ним относятся вещества описывающиеся ковалентной полярной и ионной связью. Например, растворимые кислоты, соли, основания.
- Неэлектролиты — растворы не способные пропускать через себя электричество. Это нерастворимые в воде вещества, органические соединения. Например, азот, жидкий кислород.
Фарадей, изучая процесс распада ионов, задавался вопросом, можно ли «поймать» появляющиеся анионы и катионы. Как оказалось — вполне возможно. Для этого нужно просто создать окислительно-восстановительный процесс. В результате можно собрать на одной стороне катионы, а на другой анионы. Реакции диссоциации в электролите относятся к первичным процессам, а те, что протекают при восстановлении — вторичными.
Фактически это разделение и помогло Фарадею открыть два закона. Сегодня с помощью электролиза получают определённые марки металлов, обрабатывают поверхности. В промышленных масштабах его используют для очистки магния, натрия, алюминия. Электролиз находит также применение при фильтрации сточных вод.
Опыт Фарадея
Чтобы возник ток, необходимо существование свободных носителей зарядов. Именно их направленное движение приводит к его появлению. Например, в металлах такими частицами являются электроны. Те проводники, в которых они отвечают за образование тока относят к первому роду.
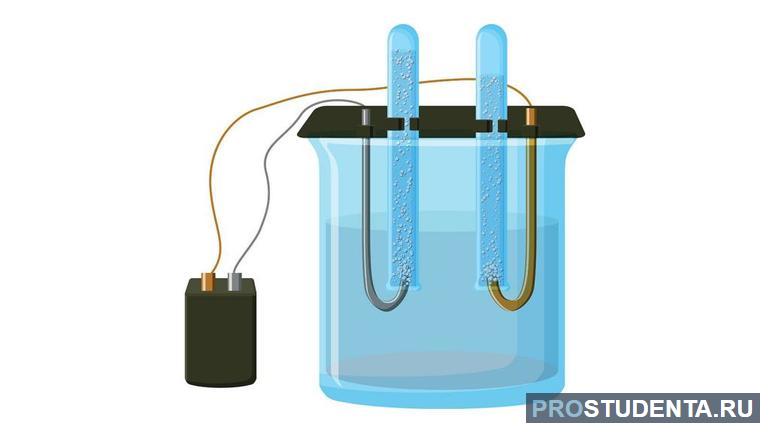
Для того чтобы выяснить, проводит ли жидкость электричество Фарадей выполнил следующий эксперимент. Он взял сосуд, в который поместил два электрода из инертного материала и подключил их к гальваническому источнику тока. В качестве измерителя он использовал электроскоп Уильяма Гильберта. Наполняя ёмкость различными жидкостями, учёный наблюдал, как изменялись показания прибора. В современной интерпретации этот эксперимент можно повторить самостоятельно так: в качестве источника энергии использовать 12 В аккумулятор, а измерителя тока — амперметр.
В результате Фарадей выяснил, что некоторые жидкости не проводят ток, то есть являются диэлектриками. Например, керосин, нефть. А другие, наоборот, отличные проводники. Например, морская вода. Интересным оказался результат с солью и чистой водой. Эти вещества по отдельности являются диэлектриками. Но если их объединить, сделать раствор, то он будет проводником. Оказалось, что при растворении появляются ионы, которые и являются носителями зарядов. Вещества, природа тока в которых связана с ними назвали электролитами. Относят их к проводникам второго рода.
Электрод, к которому подключён положительный полюс, называют анодом. Раствор представляет собой диссоциирующие молекулы. В электрическом поле, созданном источником тока, ионы начинают упорядоченное движение. Отрицательные ионы перемещаются к катоду, а положительные к аноду. Наблюдается протекание электротока. Характеризуется явление двумя процессами:
- Анион достигает катода, где он получает недостающие частица и превращается в нейтральный атом. Слой металлизированного вещества выделяется на электроде.
- Катион, попадая на анод, отдаёт свои лишние электроны. Дальше процесс зависит от того, из чего сделан анод.
Например, если анод выполнен из такого же материала, что и катион, то он начинает постепенно растворяться в жидкости. Это явление называется вторичной химической реакцией. Если же материал другого типа то выделяется кислород.
Закон электролиза
Процесс выделения вещества на электродах оказался природным. Поэтому перед учёными стала задача описать его количественно и научиться им управлять. Рассуждения физиков строились следующим образом. Чтобы найти вес выделившегося вещества на электроде нужно умножить массу одного иона на количество зарядов, которым обладают частицы, подошедшие к аноду. То есть решить уравнение: m = mi * N, mi — масса иона, N — число достигших частиц электрода.
Чтобы найти mi нужно вспомнить из химии о понятии молярной массы. Это вес вещества в количестве один моль. При этом число молекул в нём можно найти, разделив молярную массу на число Авогадро: mi = M / Na. Как только ион подошёл к электроду, он тут же будет захвачен. В результате по цепи пройдёт заряд равный энергии частицы. Значит, чтобы найти количество ионов, понадобится воспользоваться отношением: q / qi. Где: q — весь заряд равняющийся произведению силы тока на время, qi — величина, соответствующая одному иону и определяемая как n * e.
Теперь искомое выражение можно записать так: m = (M / Na) * ((I * t) / (e * n)). Эту формулу удобно переписать в следующем виде: m = I * t * (M / n) * (1 / Na * e). Полученное равенство носит название закон электролиза. Результат произведения (M / n) * (1 / Na * e) зависит от свойств вещества. Поэтому его можно представить в виде константы K. Таким образом, искомое выражение для массы будет равно: m = k * i * t.
В 1836 году об электронах, числе Авогадро и свойствах ионов было ещё неизвестно. Майкл Фарадей, изучая ток в электролитах, получил этого результат экспериментальным путём. Поэтому его и назвали первым законом, присвоив ему имя учёного. За коэффициент же k условились принимать электрохимический эквивалент вещества.
Таким образом, можно сформулировать первый и второй закон:
- при электролизе масса превращённого вещества зависит пропорционально от количества электричества, прошедшего через электролитическую ячейку;
- если через электролит пропускать одно и то же электричество, то масса превращённого вещества зависит от веса и заряда ионов: K = (1 / F) * (M / n).
Электрохимический эквивалент измеряется в [кг / Кл]. Его физический смысл заключается в массе веществ, выделившихся на электроде при прохождении через электролит заряда в один кулон. Отношение Na * e обозначают буквой F и называют постоянной Фарадея. Равна она 96 500 Кл / моль и обозначает заряд электронов, которые набрали число Авогадро.
Применение закономерностей
В 1874 году соотношение m = (1 / e * Na) * (M / n) * I * t было использовано для нахождения значения элементарного заряда. Все величины, которые входят в формулу измеримые. Например, массу можно узнать с помощью весов, малярное число есть в периодической системе элементов, силу тока померить амперметром, а время — секундомером. Поэтому если выразить из выражения элементарный заряд, то необходимые для его расчёта величины можно получить экспериментальным путём. Так, он будет равен: e = (M * I * t) / (m * Na * n).
Сейчас известно, что носителем отрицательного элементарного заряда является электрон. Но у положительных ионов он будет таким же, так как у нейтрального атома отнимается отрицательная частица. Интересно, что электрон был открыт в 1897 году, а вот его величина измерена раньше. Тогда, проводя эксперимент, учёные не смогли догадаться, что же, по сути, было вычислено. Фактически же это оказался заряд иона.
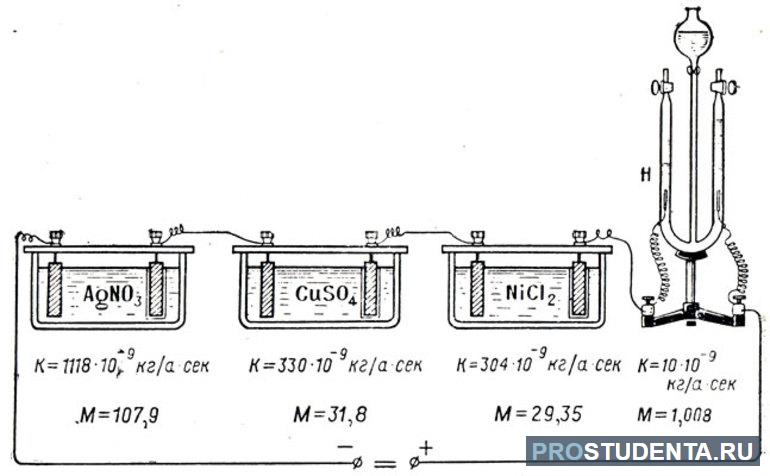
С помощью законов Фарадея можно решать различные физические задачи, связанные с электролизом. Например, определить электрохимический эквивалент натрия. Для этого можно воспользоваться формулой: K = (1 / F) * (M / n). Молярную массу натрия нужно взять из таблицы Менделеева. Она равняется 23 * 10-3 кг / моль. Так как вещество является щелочным металлом, то его валентность составляет единицу. Подставив все известные значения искомая величина будет равна: k = 23 * 10-3 [кг * моль] / 96,5 * 103 [Кл / моль] = 23 * 10-6 [ кг / Кл] = 0,24 [мг / Кл].
Решение второй задачи будет более интереснее. При никелировании изделий в течение двух часов отложился слой Ni толщиной 0,03 мм. Определить плотность тока при электролизе, если насыщенность вещества равна: p = 8,9 * 103 кг / м3. Плотность тока — это физическая величина равняющаяся отношению силы электротока к площади поперечного сечения, через который он протекает.
Никель осаждается на катоде, значит, его вектор направлен перпендикулярно поверхности Ni. Поскольку речь идёт об электролизе можно использовать формулу: m = kit. С другой стороны, m = p * S *L. Эти две формулы можно объединить. В итоге получится: k * I * t = p * S *L. Левую и правую часть можно разделить на S * k * t. Тогда получится равенство: I / S = (p * L) / k *t → j = (p * L) / k * t = (8,9 * 103 кг /м3 * 3 * 10−3 *10−2 м * Кл) / (3 * 107 кг* 2 * 3,6 * 103 с) = 120 А / м2. Задача решена.
Уметь рассчитывать плотность тока важно. Если она окажется слишком большой, то слой осаждённого вещества окажется рыхлым. Связано это с неравномерной скоростью осаждения. Кроме этого, с помощью анодного растворения можно затачивать вещества толщиной до одного атома при правильно подобранном токе.
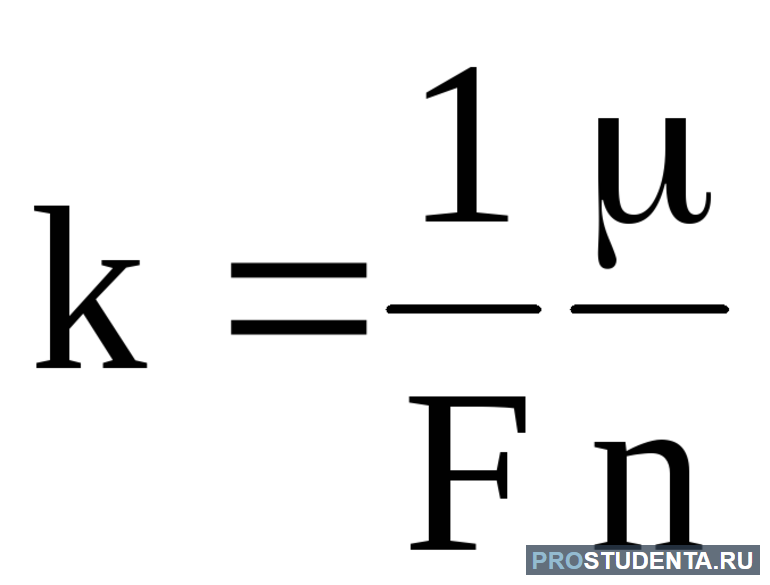


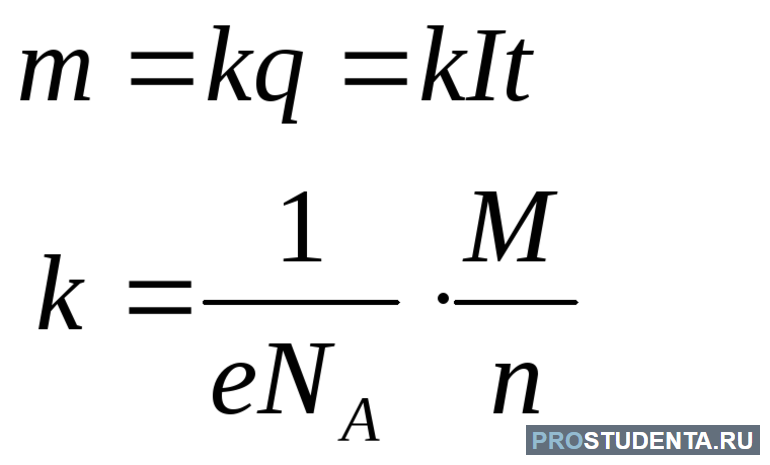



Ещё никто не комментировал эту статью. Оставьте комментарий первым!