Кратко о моделях строения атомов химических элементов
В школьном курсе химии и физики изучается теория строения атома. Кратко описать структуру внутреннего устройства веществ помогает периодический закон Д. И. Менделеева в современной трактовке. Изменения свойств элементов и их соединений напрямую зависят от строения составляющих их частиц.
Оглавление:
Как устроен атом
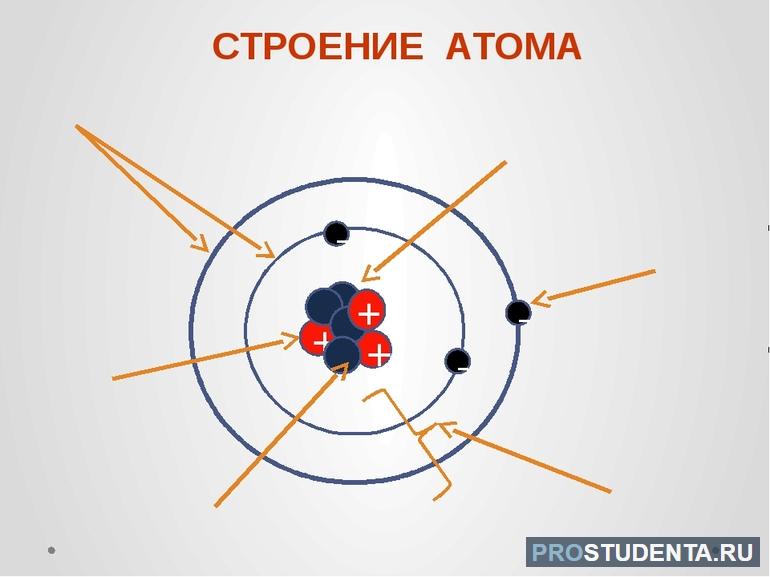
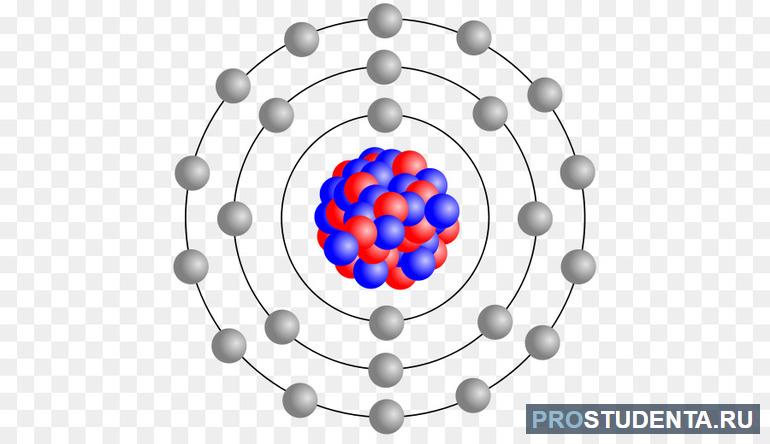
Слово ἄτоμоς на древнегреческом языке означает «неделимый, неразрезаемый». Так с древних времен называли наименьшую частицу вещества. Атом состоит из ядра и электронов. Эту систему можно сравнить с Солнцем и планетами. Большую часть массы составляет ядро (более чем 99.9%). Оно состоит из протонов — положительно заряженных частиц, и нейтронов, которые не имеют заряда. Оболочку ядра составляют электроны, которые практически не имеют веса. Эти частицы заряжены отрицательно.
Устройство ядра
Протоны, нейтроны и электроны — 3 главные составляющие атома. Количество этих частиц для каждого элемента можно найти в периодической таблице Д. И. Менделеева. Численность протонов и электронов равна порядковому номеру в системе. Это определяет его принадлежность к определенному веществу. Число нейтронов равно разности относительной атомной массы и порядкового номера. Это количество может варьироваться от нуля до нескольких десятков:
- Протоны — элементарные частицы, обладающие положительным зарядом и имеющие массу 1,675 * 10 (в степени -24) г. Они участвуют в образовании ядра и принимают участие в термоядерных реакциях.
- Нейтроны — электронейтральные (не имеющие заряда) частицы ядра атома с массой равной 1,673 * 10 (в степени -24) г. Они входят в состав центральной части.
- Электроны — отрицательно заряженные частицы, расположенные на энергетических уровнях вокруг ядра. Они образуют электронную оболочку атома.
Основные свойства
Каждый химический элемент состоит из атомов, имеющих определенный заряд ядра (количество протонов). Однако часто встречаются разновидности, которые, будучи одинаково заряженными, имеют разную атомную массу. Такие вещества называют изотопами, они определены и известны для каждого элемента. Это понятие происходит от греческого isos — «равный», topos — «место», так как они занимают одно и то же положение в периодической системе, поэтому атомные массы в периодической таблице являются средним значением всех изотопов определенного вида атомов.
Из этого важного факта следует, что самой важной отличительной чертой химического элемента является заряд ядра и количество протонов и электронов. Атомные массы не могут быть основной характеристикой, поскольку они подвержены изменениям. Численность нейтронов (n) в каждом изотопе разная, именно поэтому появляется разница в весе.
Некоторые атомы обладают свойством непроизвольно излучать невидимые глазу частицы. Это явление называется радиоактивностью и проявляется у нестабильных изотопов, когда радиус ядра больше длины действия сильных взаимодействий.
Исторические модели
В течение долгого времени ученые пытались наглядно представить, как могут выглядеть атомы. Чтобы доказать верность модели, необходимо выдвинуть теорию, обосновать ее и подтвердить экспериментами. Ученый выдвигает предположения, что должно происходить, если его идея верна. Если в ходе эксперимента эти прогнозы подтверждаются, теорию можно считать правильной. По мере поступлений новых сведений об устройстве веществ, представления науки меняются:
- В 1904 году Дж. Томсон предложил свою модель атома — «Пудинг с изюмом». Теория предполагала, что внутри положительно заряженного тела находились отрицательные электроны. Необычное название происходит от сходства частиц с изюмом в традиционном английском пудинге по их произвольному расположению в нем. Позже Резерфорд опроверг эту модель.
- Почти одновременно с Томсоном разработал свою идею японский физик Нагаока. Он построил раннюю планетарную модель атома (она имела сходство с планетой Сатурн). По схеме кольца, состоящие из электронов, вращались вокруг ядра с положительным зарядом. Позже было доказано, что теория неверна.
- В 1911 году Э. Резерфорд после многих опытов пришел к выводу, что атом по своему строению напоминает планетарную систему, так как электроны перемещаются вокруг ядра по осям, подобно планетам.
Парадокс заключался в том, что, несмотря на опытные доказательства, модель противоречила правилам классической науки. По законам обычной механики электроны должны были бы падать на ядро вследствие потери энергии. После этого датский физик Нильс Бор доказал, что они удерживаются на «орбите» ядра за счет его положительного заряда. Электроны не излучают энергию.
Таким образом, люди выяснили, что внутри атомов действуют совсем другие законы природы. Это послужило началом новой отрасли науки — квантовой механики, правила которой отличаются от классической. А планетарная теория получила название модель Бора-Резерфорда.
Строение электронных оболочек
Электроны, вращаясь вокруг ядра, расположены на определенных уровнях, отдаленно напоминающим орбиты, по которым планеты вращаются вокруг Солнца. Сходство это чисто условное, так как большую часть времени эти частицы летают по непредсказуемым траекториям. Но все-таки хаотичное движение электронов происходит внутри определенной области, которую ученые называют орбиталь. Количество их у разных элементов разное. Число орбиталей для какого-то определенного элемента совпадает с номером периода, в котором он расположен в периодической таблице.
Также установлено максимальное количество заряженных частиц на определённых электрических уровнях. На первом (самом близком к ядру) слое могут находиться максимум 2 электрона, во втором — 8, в третьем — 18, в четвертом — 32. Максимальное число отрицательно заряженных частиц можно определить по формуле 2 (n*n), где n — номер энергетического уровня.
Слой, в котором находиться максимальное для него количество электронов, называется завершенным электронным уровнем.
С таким представлением об электронной оболочке связано свойство валентности. По определению, термин означает способность атомов вступать в химические связи с другими элементами. Это происходит за счет незаполненных мест электронных оболочек. Электроны способны отрываться и улетать, подобно кометам в космосе. Атомов всегда стремятся заполнить эти пустоты за счет свободных электронов других веществ. Таким образом происходит процесс химических связей и образования новых соединений.
Примеры описания
Атом водорода (H) имеет в периодической системе Д. И. Менделеева порядковый номер 1, соответственно, заряд ядра равен +1, элемент имеет один энергетический слой, в котором движется 1 электрон (e). Так как на первом s-уровне могут находиться 2 e, а у H он только 1, значит, здесь незавершенный электронный уровень.
Следующий элемент в периоде под номером 1 — гелий (He), следовательно он имеет заряд ядра +2, один электронный уровень, но с двумя отрицательно заряженными частицами и энергетический уровень завершен.
Современные направления исследований
В настоящее время ученые работают на субатомном уровне, то есть изучают частицы, которые во много раз меньше атомов. К ним относятся кварки, фотоны, глюоны. Эти, казалось бы, совсем незаметные частицы способны выделять огромную энергию. Свойства их еще практически не исследованы. Ученые ставят сложнейшие опыты, сталкивая частицы друг с другом в огромных установках-ускорителях.





Ещё никто не комментировал эту статью. Оставьте комментарий первым!