Химические свойства и применение альдегидов
Специфичность химических свойств альдегидов обусловлена входящей в состав вещества альдегидной группы (карбонильной группы С=О, соединенной с атомом водорода). Выделяют 6 реакций: присоединительные (в т. ч. восстановления), полимеризации, окисления, замещения, поликонденсации и диспропорционирования. Взаимодействия, позволяющие определить наличие альдегида в составе смеси, носят название «качественные реакции».
Оглавление:
Специфичность химических свойств альдегидов обусловлена входящей в состав вещества альдегидной группы (карбонильной группы С=О, соединенной с атомом водорода). Выделяют 6 реакций: присоединительные (в т. ч. восстановления), полимеризации, окисления, замещения, поликонденсации и диспропорционирования. Взаимодействия, позволяющие определить наличие альдегида в составе смеси, носят название «качественные реакции».
Понятие альдегида
Альдегидом называют химическое вещество, в состав которого входит альдегидная группа и углеводородный радикал. Общую формулу предельного альдегида кратко можно записать: C (n)H (2 n) O. Альдегидная группа всегда расположена при первом атоме углерода.
Повышенная полярность связи С=О обуславливает два свойства:
- высокую полярность связи углерода с водородом;
- дефицит электронной плотности атома С альдегидной группы.
Первым в ряду альдегидов расположен формальдегид. В нем роль углеводородного радикала отведена молекуле водорода. Формальдегид самый активный. Его физическое состояние в нормальных условиях газообразное.
Альдегиды состава С (2)-С (12) в жидком агрегатном состоянии, а от С (13) и выше — в твердом.
Присоединительные реакции
Конечные продукты, образующиеся в результате присоединения, разнообразны и зависят от того, с чем реагируют альдегиды:
- С циановодородной (синильной) кислотой HCN. В результате образуются циангидрины, в состав которых входит цианогруппа и гидроксильный остаток. В составе циангидрина на 1 атом С больше, чем в исходном продукте, поэтому взаимодействие проводят для увеличения углеродной цепи.
- С 1−2 молекулами спирта с образованием полуацеталей и ацеталей. Реакция протекает в присутствии кислоты или основания.
- С реактивом Гриньяра. После гидролиза конечного продукта с водой образуются спирты. При взаимодействии с формальдегидом возможно восстановление до первичного спирта, все остальные дают вторичные спирты.
- С гидросульфитом натрия. Качественная реакция проводится для получения альдегидов в чистом виде путем выделения их из смеси. Гидросульфитное производное выпадает в виде кристаллов.
- С аммиаком. Взаимодействие приводит к образованию иминов.
Формальдегид и ацетальдегид также взаимодействуют с водой. Вода присоединяется к карбонильной группе, в результате исходное вещество существует в гидратной форме.
Реакция восстановления
Частный случай присоединительной реакции. В процессе восстановления степень окисления атома С альдегидной группы понижается. Восстановление происходит в присутствии катализатора (металлов: никеля, платины, палладия) и при нагреве. Другое название процесса — гидрирование, так как реакция протекает путем присоединения атомов водорода. Восстановленный альдегид представляет собой первичный спирт.
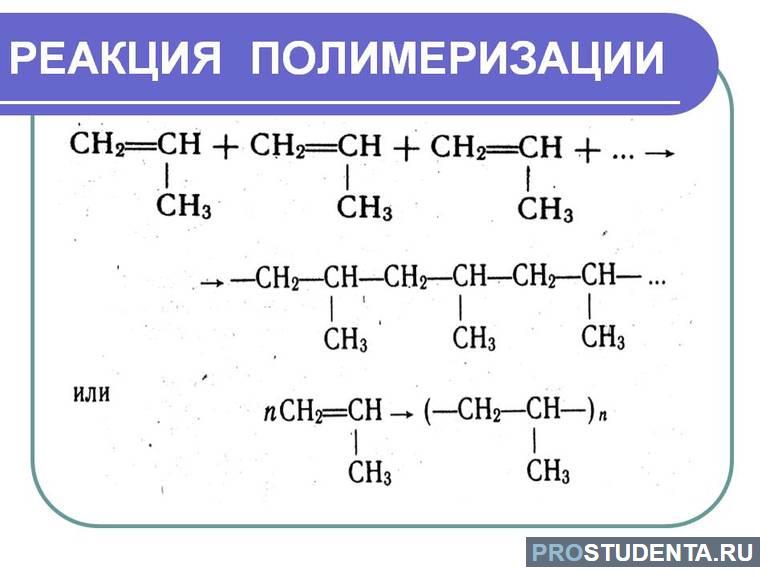
Реакция полимеризации
Еще одним частным случаем присоединительной реакции выступает полимеризация. Она характерна для низших альдегидов. Различают два вида полимеризации:
- линейная (происходит в результате испарения или длительного стояния);
- циклическая (требует вмешательства катализаторов).
Продукты циклической полимеризации зависят от условий протекания процесса. Так, ацетальдегид может образовывать как жидкий паральдегид (при комнатной температуре проведения полимеризации), так и твердый метальдегид (при нулевой температуре). Катализатором выступает серная кислота.
Реакция окисления
Альдегиды окисляются под воздействием кислорода воздуха или слабого окислителя, переходя в карбоновые кислоты. Процесс протекает по связи С-Н. Углерод обладает положительным зарядом, в связи с чем притягивает электроны водорода. Поэтому последний проявляет высокую реакционную способность.
Качественной реакцией выступает взаимодействие с аммиачным раствором оксида серебра. Конечные продукты: ацетат аммония, аммиак, вода и чистое серебро, осаждающееся на границе сосуда.
Другие качественные реакции основаны на цветовой индикации:
- Гидроксид меди имеет голубой цвет. Окисляя альдегид, медь (+2) восстанавливается до меди (+1). Полученное основание CuOH неустойчиво и распадается на оксид меди и воду. Оксид выпадает в виде красно-оранжевого осадка.
- Фуксиносернистая кислота бесцветна. Под влиянием альдегида раствор приобретает фиолетовый оттенок.
- Нагрев раствора перманганата калия с серной кислотой приведет к его обесцвечиванию, если в смеси присутствовал альдегид. В уравнении реакции формальдегида среди конечных продуктов отсутствует карбоновая кислота, но появляется углекислый газ. Это связано с неустойчивостью муравьиной кислоты.
Горение альдегидов сопровождается характерным для всех органических элементов выделением углекислого газа и воды.
Реакция замещения
Водород, связанный с а-атомом углерода, может замещаться галогенами. Процесс носит название а-галогенирование, а продукты замещения называются лакриматорами.
Реакция замещения иллюстрируется пробой Люголя. В перенасыщенном растворе йода выдает присутствие альдегида желтый осадок — йодоформ. Катализатором выступает щелочь.
Реакция поликонденсации
Во время поликонденсации образуются новые углеродные связи, что приводит к появлению высокомолекулярных соединений. Процесс сопряжен с высвобождением молекул воды, соляной кислоты или других веществ.
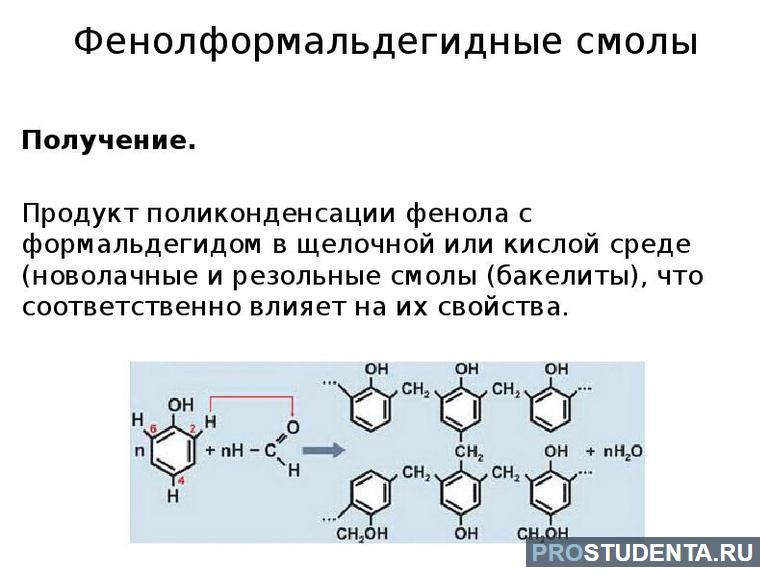
Фенолформальдегидные смолы образуются путем конденсации формальдегида с фенолом. Молекулы исходных веществ объединяются в фенолспирт. Катализатором выступает основание или кислота. Получившееся вещество вступает во взаимодействие с молекулами фенола. Поликонденсация сопровождается выделением воды. Сконденсированный продукт взаимодействует с формальдегидом. Следующий шаг — реакция с фенолом, потом с формальдегидом и так далее.
Процесс производства мочевиноформальдегидных смол основан на поликонденсации альдегидов с карбамидом, меламиноформальдегидных — с меламином.
Катализатором альдольной конденсации являются разбавленный раствор щелочи. Карбонильные группы двух молекул объединяются, образуя альдоль.
Нагрев альдегида или воздействие на него кислоты обуславливает кротоновую конденсацию (переход к непредельному альдегиду из предельного через альдоль). Процесс сопровождается выделением воды.
Реакция диспропорционирования
Встречается под названиями самоокисление-самовосстановление, или реакция Канниццаро. Условия протекания: воздействие щелочной среды на альдегид, а-углерод которого не связан с атомом водорода. Продукты диспропорционирования: спирт (восстановление), карбоновая кислота (окисление).
Применение альдегидов
Хим. свойства альдегидов нашли применение в промышленности. Присоединительные реакции взаимодействия со спиртом используют для получения ацеталей. Их запах можно описать как приятный, цветочный. Продукт взаимодействия бутиральдегида с поливиниловым спиртом используется при производстве безосколочных стекол (выполняет функцию клея). Продукты полимеризации используют для изготовления пленок, волокон. Метальдегид получил распространение в быту (более известен как «сухой спирт»).
В производстве зеркал, украшений, игрушек и т. п. используется реакция серебряного зеркала (окисление ацетальдегида аммиачным раствором оксида серебра). Выделяющийся в процессе реакции драгоценный металл осаждается на стенках сосуда, образуя декоративную зеркальную поверхность.
Лакриматоры (продукты реакции замещения) имеют слезоточивое действие. Часть из них (хлорацетофенон, бромацетон, хлорпикрин и другие) используют в полицейских и военных целях.
Фенолформальдегидные смолы нашли применение в производстве пластмасс. Меламиноформальдегидными смолами пропитывают материалы для придания им водостойкости и несминаемости. Альдольная конденсация используется для производства каучуков, смол, лаков и других веществ.






Ещё никто не комментировал эту статью. Оставьте комментарий первым!