Диффузия в газах: примеры и опыты, значение в жизни человека
Классическое атомно-молекулярное учение является теоретическим фундаментом разных естественных наук и позволяет обосновать многие происходящие в природе явления. Одним из таких процессов является диффузия.
Оглавление:
С ней дети знакомятся на уроках физики. Проявление одного из видов этого явления — диффузии в газах — можно встретить во взаимодействии живых и неживых объектов природы, а также в практической деятельности человека.
Теория диффузионных процессов
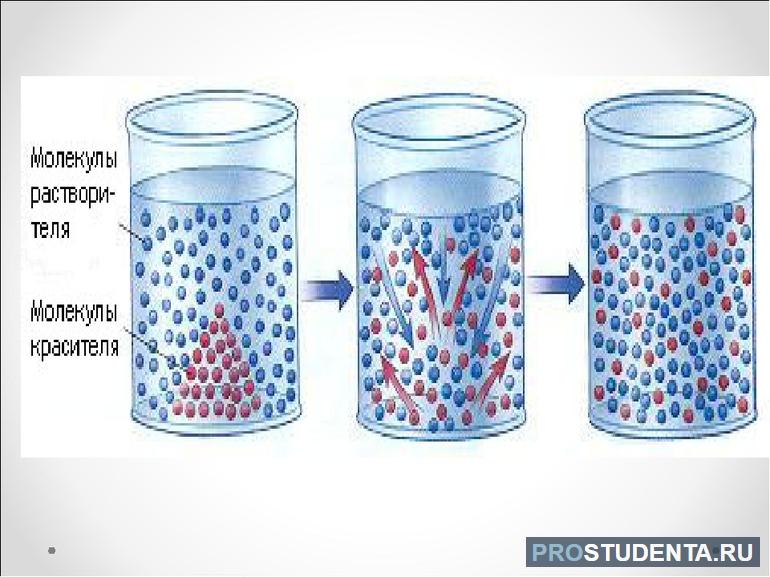
В школьном курсе физики диффузия определяется как взаимное проникновение молекул одного вещества между молекулами другого, обусловленное их хаотическим тепловым движением. Причиной процесса является свойственное всем физическим системам стремление к состоянию равновесия, а результатом — равномерное распределение диффундирующих веществ по занимаемому объёму.
История исследования
Первым и наиболее наглядным экспериментальным примером процесса служит броуновское движение микроскопических частиц твёрдого вещества в жидкой или газовой среде, открытое в 1827 году британским ботаником Робертом Броуном. В дальнейшем термин «диффузия» стал применяться только для описания процессов, происходящих на молекулярном уровне:
- В этом же году французский учёный Рене Дютроше опубликовал результаты исследований по разделению жидкостей с помощью мембран. На основании опытов с растворами солей, этанолом и маслами им была установлена зависимость скорости диффузии от разности плотностей или концентраций веществ.
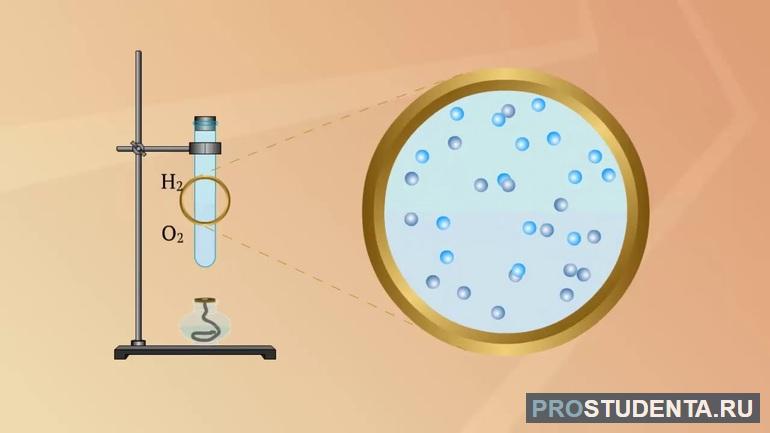
- Австрийский физик Лошмидт изучил процесс взаимного проникновения углекислого газа и водорода, при этом условия опыта обеспечивали смешивание газов только за счёт молекулярного движения. Учёным был сделан вывод, что соприкасающиеся газы всегда диффундируют друг с другом, за исключением химического взаимодействия веществ. Кстати, и броуновское движение, и диффузия относятся к физическим явлениям, поскольку в процессах не происходит изменений молекул и химического состава веществ.
- Английский учёный Томас Грэм начал свою научную деятельность с исследования диффузии применявшегося в XIX веке для освещения городов светильного газа. Впоследствии Грэм разработал метод выделения из воздуха кислорода и азота, методы мембранного разделения и диализной очистки растворов и газовых смесей, вывел закон эффузии (как закон Грэма) об истечении газов через пористую поверхность или искусственную мембрану.
- Анализы этих и других исследований дали немецкому физику Адольфу Фику повод провести аналогию между процессами теплообмена и массообмена при диффузии. В результате математическая теория теплопроводности Фурье была применена Фиком для теоретического обоснования диффузионных процессов.
Эти работы позволили сформулировать современное определение диффузии как физического процесса взаимного проникновения молекул или атомов одного вещества между молекулами другого или других веществ, приводящего к самопроизвольному выравниванию их концентраций.
Закон Фика
Количественная теория диффузии, названная впоследствии в честь ученого законом Фика, была представлена в 1855 году. Путем исследований соляных растворов Фик пришел к выводу, что свободная диффузия происходит по законам, аналогичным законам распространения тепла. В основе обоих явлений лежит механизм молекулярного переноса, в одном случае — массы, в другом — энергии.
В одном из первых определений физический смысл закона раскрывался так: количество вещества, проходящее за известное время в направлении убывающей концентрации через элемент поверхности, пропорционально величине этого элемента поверхности, промежутку времени, величине убывания концентрации по направлению течения.
Современная формулировка закона Фика выглядит следующим образом: «Скорость диффузии вещества пропорциональна площади поверхности, через которую переносится вещество, и градиенту концентрации этого вещества».
Математическое уравнение диффузии выражается формулой: Δn/Δt=D∙S∙(ΔC/Δx), где:
- Δn — количество переносимого вещества (диффузионный поток), моль;
- Δn/Δt — скорость диффузии, моль/с;
- D — коэффициент диффузии, м²/с;
- S — площадь поверхности, м²;
- ΔC/Δx — градиент концентрации, моль/м⁴.
Количественными характеристиками процесса являются: градиент концентрации (уменьшение концентрации на единицу длины) и коэффициент диффузии, определяемый свойствами среды и типом диффундирующих частиц. Для газовых сред коэффициент диффузии D обратно пропорционален давлению газа, увеличивается пропорционально росту температуры (при постоянном объёме), уменьшается с увеличением молекулярной массы.
Для наглядности можно привести данные значения коэффициента D для некоторых случаев односторонней диффузии веществ в различных агрегатных состояниях.
| Диффундирующее вещество | Основное вещество | Температура, °C | Коэффициент диффузии, м²/с |
| Водород (газ) | Кислород (газ) | 0 | 0,70∙10-4 |
| Пары воды | Воздух | 0 | 0,23∙10-4 |
| Пары этиленового спирта | Воздух | 0 | 0,10∙10-4 |
| Соль | Вода | 20 | 1,10∙10-9 |
| Сахар | Вода | 20 | 0,30∙10-9 |
| Золото (твёрдое) | Свинец (твёрдый) | 20 | 4∙10-14 |
| Свинец (твёрдый) | Самодиффузия | 285 | 7∙10-15 |
Особенности явления в газовых средах
Основной характеристикой диффузионных процессов является их скорость, которая зависит от нескольких факторов: агрегатного состояния вещества, температуры и внешних воздействий. Так как механизмом процесса является молекулярное движение, диффундирование происходит в веществах, находящихся в любом агрегатном состоянии.
Газообразные среды характеризуются наибольшей скоростью смешивания частиц, что обусловлено свободным объёмным размещением атомов и молекул. На них не распространяются физические понятия упорядоченности частиц, дальнего и ближнего порядка их взаимного расположения, применяемые для твёрдых, жидких и аморфных веществ. По этой же причине для газовых сред более значительно на скорость диффундирования влияет изменение температуры и плотности, так как в обоих случаях сопротивление движению молекул за счёт межатомных связей практически не изменяется.
Эти положения подтверждаются и данными приведённой выше таблицы. Значение коэффициента диффузии в газовых средах на 5 порядков (в тысячи раз) превосходит значения для жидких сред и на 10 порядков (в сотни миллионов раз) — для твёрдых тел.
Примеры из природы и жизни человека
Диффузионные процессы в газовых средах являются одними из наиболее распространённых в природе, а их проявления окружают человека в его естественной жизнедеятельности, в быту, технике и промышленности. Можно привести достаточное количество простых примеров диффузии в газах, известных по повседневной жизни:
- Диффузия атмосферного воздуха — одно из условий возникновения и сохранения жизни на нашей планете. Благодаря процессу поддерживается постоянный и необходимый для живых организмов состав газовой смеси в нижних слоях земной атмосферы.
- Дыхание человека и животных обеспечивается постоянным газообменом воздуха в лёгких. В результате газовой диффузии кислород поступает из вдыхаемого воздуха в клетки крови, а углекислый газа из крови — в выдыхаемый воздух. Необходимая скорость процесса поддерживается за счёт разности парциальных давлений газов в альвеолярном воздухе и крови.
- Диффузия углекислого газа является условием фотосинтеза растений. При поглощении газа клетками растительных волокон на их поверхности возникает градиент концентрации, вызывающий направленное движение газа из окружающего воздуха к фотосинтезирующим органам растения.
- Диффузионные процессы определяют распространение в воздухе запахов, имеющих огромное значение в жизни живых организмов. С их помощью определяется источник пищи или опасности, находится дорога к дому или передаётся информация. Для таких древних и сложных сообществ, как пчелиный рой или муравьиная колония, запаховая сигнализация служит способом коммуникации.
Явление газовой диффузии нашло применение во многих изобретениях человека. Для научных и практических задач основным значением процесса служит управление концентрациями вещества в неоднородных средах. Одни примеры такого применения известны больше, другие — меньше:
- Многообразные парфюмерные ароматические изделия — духи, одеколоны, дезодоранты, освежители, применение которых без диффузии трудно представить.
- Диффузия помогает обеспечить безопасность при использовании природного газа. Как известно, применяемый в быту и производстве природный газ метан не имеет собственного запаха. Чтобы вовремя обнаружить его утечку, на газораспределительных станциях в него добавляют специальную жидкость этилмеркаптан с резким характерным запахом.
- В промышленности, энергетике и санитарии механизм диффузии используется в системах ионной очистки газов.
- В космической отрасли явление газовой диффузии служит как причиной многих проблем, так и способом их решения. Одной из проблем является истечение воздуха сквозь материалы космического корабля, в связи с чем его запасы на борту МКС приходится постоянно возобновлять с Земли. Одновременно с этим очистка бортового воздуха от углекислого газа производится на газодиффузионных установках.
- Закон Грэма лежит также в основе атмолиза — газодиффузионного метода, применяемого в атомной технологии для разделения изотопов при обогащении урана.
Любопытным для многих будет факт, что упомянутый закон Грэма имеет практическое отношение и к любимым детьми воздушным шарикам.
Дело в том, что резиновые шары, наполненные гелием, теряют свой объём значительно быстрее накачанных воздухом. Эту информацию стоит взять на заметку многим родителям.







Ещё никто не комментировал эту статью. Оставьте комментарий первым!