Строение молекулы и молярная масса бензола
Бесцветную жидкость со сладковатым запахом называют бензолом. Строение молекулы органического химического соединения интересно тем, что оно представляет собой шесть атомов углерода, связанных с водородом. Скелет структуры образует правильный шестиугольник. Вещество является родоначальником ароматических углеводов и содержит одно связующее кольцо.
Оглавление:
Общие сведения
Молекулярная формула вещества — C6H6. Относится бензол к группе аренов — соединений, включающих в свой состав бензольное кольцо (строение с циклическим расположением атомов углерода). Получен он был синтетическим методом в 1825 году английским химиком и физиком Майклом Фарадеем. Ученый добыл его путём химической реакции при использовании китового жира. В дальнейшем при производстве бензола применяли фракции каменноугольной смолы. В середине прошлого века этот способ получения был заменён более выгодным — дегидрогенизацией нефтяного сырья.
При открытии вещества была установлена относительная плотность паров и количественное соотношение между атомами элементов, входящих в его состав. Используя эти данные, Фарадей вывел эмпирическую формулу соединения — C2H2. Но в ней была ошибка.
Ранее считалось, что атомная масса углерода составляет шесть атомных единиц масс. Ошибку исправил в 1834 году Митчерлих. Ему удалось выделить бензол с помощью сухой дистилляции бензойной кислоты в извести. Он получил правильную формулу C6H6 и назвал соединение бензином. Однако позже название заменили на бензол. Оно и было принято в IUPAC. Сегодня получение вещества возможно:
- коксованием каменноугольного сырья;
- каталитической ароматизацией бензофракций нефти;
- пиролизом нефтефракций;
- тримеризацией этина.
Соединение относится к распространённым и важным химическим продуктам. С его помощью выполняют синтез таких веществ, как этилбензол, кумол, циклогексан, мирабановое масло, хлорбензол. В определённых реакциях бензол выступает растворителем, так как относится к «органической воде» и способен разлагать почти все органические соединения.
В чистом виде бензол не используют. Основную массу произведённого вещества направляют на получение фенола, используемого в изготовлении капрона, красителей, лекарств и химических препаратов для удобрения. Из вещества производят анилин и малеиновый ангидрид, из которых изготавливают синтетические волокна, каучуки, пластмассы.
Бензол используется и как топливная добавка для повышения октанового числа. Запах органического вещества связан с устойчивостью бензольного ядра.
Физические и химические свойства
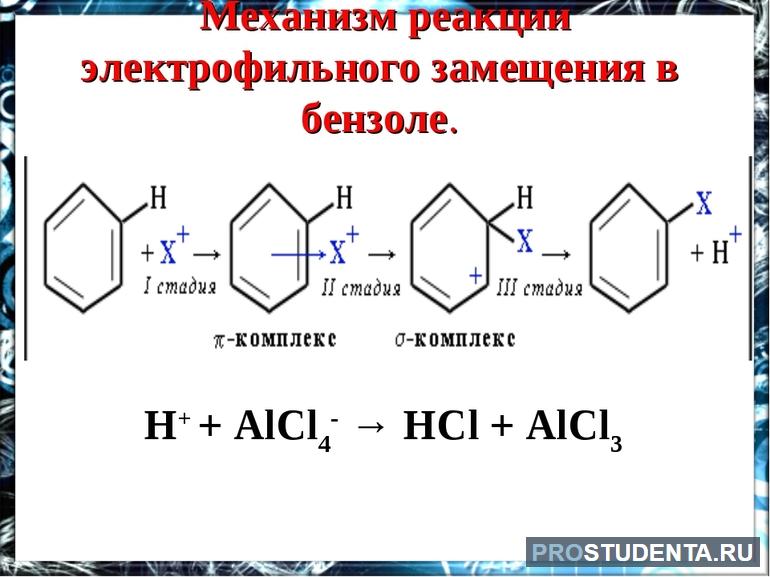
Органическому соединению свойственна реакция замещения. Оно вступает в реакцию с кислотами (нитратной и сульфатной), олефинами, галогенами. Электрофильное замещение происходит в несколько этапов. Сначала образуется π-комплекс между катионом поляризованной молекулы Eσ + -Nuσ- и бензолом. Затем часть p-электронов покидает сопряжённое кольцо и образует σ-связи с электрофилом. Полученное соединение характеризуется положительным зарядом и отсутствием запаха.
Вещество имеет отличную способность смешиваться с эфиром, бензином и другими растворителями органического образования. При растворении в водном растворе возникает анизотропная смесь. Для её появления необходимо растворить 1,79 г вещества в литре H2O и нагреть раствор до 25 °C. Процесс горения сопровождается появлением копоти. Для соединения характерны следующие параметры:
- Молярная масса — 78,11 г/моль.
- Плотность — 0,897 г/ см³.
- Температура плавления — 5,5 °C.
- Точка кипения — 80,1 °C.
- В ультрафиолетовом спектре наблюдается поглощение полос размером 5—6 нм.
Алкилирование и ацетилирование осуществляется алкилгалогенидами, алкенами и спиртами, характеризуются катализируемыми кислотами Льюиса. В качестве примера реакции можно привести этилирование бензола хлорэтона. Продуктами ацилирования бензола являются ароматические кетоны.
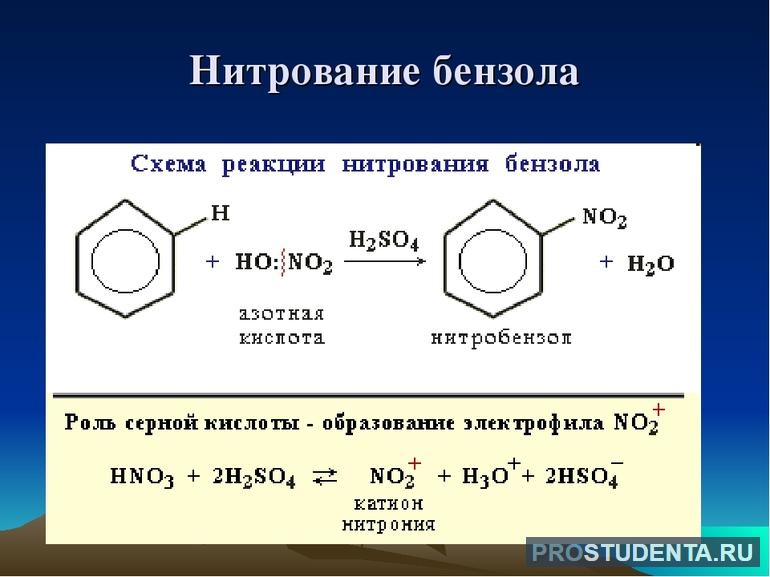
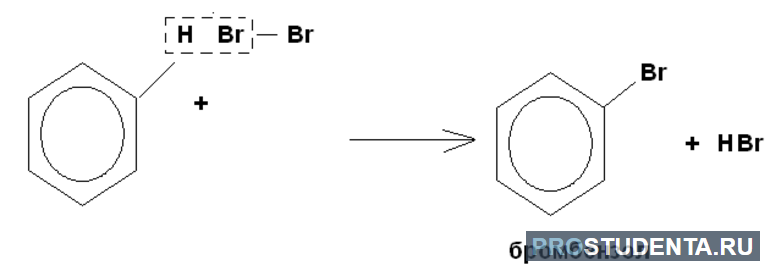
Галогенирование не приводит к обесцениванию бромной воды. Для нитрования характерно образование нитробензола, которое предшествует синтезу анилина. В реакцию присоединения бензол практически не вступает. Это связано с тем, что при нагревании образовывается циклогексан. Продуктом полного присоединения является гексахлорциклогексан.
Смесь паров бензола с воздухом может привести к взрыву. Но при этом он устойчив к окислителям, например, к воздействию раствора азотной кислоты и перманганата калия. В то же время соединение окисляется озоном. Эта способность и использовалась для изучения его строения.
Следует отметить, что вещество токсично, хоть и имеет приятный запах. При его вдыхании могут появиться головная боль и головокружение, возможна потеря сознания. Пары вызывают раздражение слизистой оболочки глаз.
Строение соединения
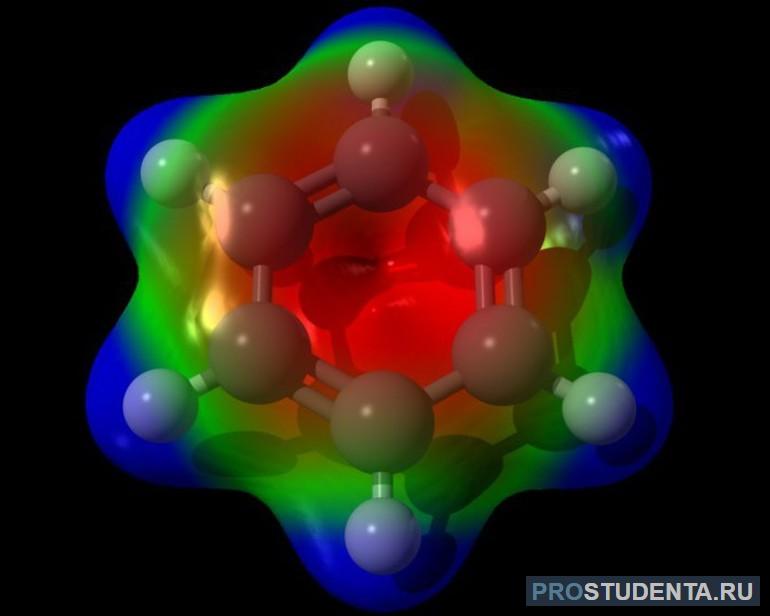
Молекулярная формула вещества записывается как C6H6. Форма соединения доподлинно была установлена с помощью рентгенографического способа. По снимку было выявлено, что молекула представляет собой плоский шестигранник. В вершинах элемента располагаются атомы карбона (угля). Связи между атомами равны между собой, а их длина составляет 0,140 нанометров. Бензол относится к неполярным соединениям с нулевым дипольным моментом.
Для атома углерода характерна гибридизация бензола sp2. В нём пребывают все атомы карбона. Интересно, что ещё в 1865 г. немецкий химик Кекуле предположил циклическую структурную формулу бензола, представляющую правильный шестиугольник. Пришёл он к этому, используя идею чередования в бензольном кольце простых и двойных связей. Неспособность присоединений галогеноводородов Кекуле объяснял осцилляционной гипотезой, согласно которой в бензоле простые и двойные связи постоянно меняются местами.
В устройстве молекулы три гибридные орбитали расположены под углом 120 градусов, образовывая C—C та C—H σ-связи. Негибридного p-типа орбитали располагаются перпендикулярно к плоскости молекул и образуют сплошное электронное кольцо. Это суперпозиция двух резонансных структур. С точки зрения молекулярных уровней структуру можно рассматривать как делокализацию вдоль шестиугольных атомов трёх π-орбиталей сдвоенных C=C связей. Присутствие сплошного π-облака, в составе которого находятся шесть электронов, и приводит к появлению излучения молекулой запаха.
Карбоновый скелет молекулы в литературе часто называют бензоловым кольцом или ядром. Практически все соединения, имеющие в своём составе кольца, получают из бензола, например, стирол, фенол, анилин, галогензамещённые арены. Электроны, расположенные на p-орбитали, взаимодействуют путём бокового перекрещивания соседних 2р-АО. Находятся они строго перпендикулярно площади s-скелета бензольного ядра и формируют общее p-электронное облако циклического характера, занимающее пространство вокруг кольца.
Таким образом, в молекуле бензола между углеродными молекулами простые и двойственные связи отсутствуют. Атомы детализованы. Из-за этого структурную формулу вещества изображают как шестиугольник (s-скелет) с кружком внутри. Последний и обозначает делокализованные p-с области.
Производные вещества
На уроках химии в девятом классе при изучении органических соединений производным бензола уделяют мало внимания или вовсе не упоминают о них. Между тем в школьных рефератах такая тема появляется довольно часто. Все производные соединения объединены связью углерода с водородом в виде бензольного кольца и запахом.
В виде заместителей могут находиться не только отдельные атомы, но и целые группы. Например, это могут быть галогены, сульфогруппы, нитрогруппы, аминогруппы, карбонильные, гидроксильные и карбоксильные группы.
Самым ярким представителем является бромбензол. Его молярная масса — 157 г/моль. Производная бензола состоит из шести атомов углерода, пяти — водорода и одной молекулы брома. Из-за различных примесей жидкость получается желтоватого цвета. Формула соединения — C6H5Br. Применяется в катализируемых палладием кросс-сочетаниях, например, в реакции Судзуки.
Из производных также можно отметить фторбензол и хлорбензол. Первый получают проведением реакции специального мольного отношения нитрита натрия к соляной кислоте и осаждением тетрафторбората фенилдиазония, который затем пиролизуют. Второй продукт является реакцией фенола с хлоридом фосфора. Выделяют соединение после сложной процедуры промывки, нейтрализации и сушки. Формула вещества — C6H5Cl.
Для всех соединений характерны реакции электрофильного замещения. При этом следует знать, что присутствие акцепторных заместителей приводит к снижению электронной плотности. Это вызывает реакцию нуклеофильного замещения. Довольно редко, но встречается мономолекулярный механизм, например, декарбоксилирования. Проходящая реакция напоминает замещение гидроксида: Li2O + H20 = LiOH.
Какое бы производное ни рассматривалось, число связей, которые формируются из шести атомов углерода и водорода, будет всегда равно двенадцати. Так как прочность у ядра бензола довольно высокая, он легко вступает в реакции замещения, образуя различные производные соединения.




Ещё никто не комментировал эту статью. Оставьте комментарий первым!