Классификация неорганических веществ в химии
Без изучения классификации неорганических веществ невозможно понять механику образования соединений. Знание особенностей групп позволяет предсказать исход любой химической реакции. Вещества принято делить на простые и сложные. Для освоения темы необходимо знать номенклатуру, строение и особенности классов соединений.
Оглавление:
Простые вещества
Соединение, образованное одним видом химического элемента, называют простым веществом. Сюда относят кислород, азот, литий и остальные структуры, представленные в таблице Менделеева. Все вещества подразделяются на металлы и неметаллы.
К самым ярким представителям группы металлов можно отнести железо (Fe), алюминий (Al), литий (Li). Химические свойства основных классов этих неорганических соединений:
- способность отдавать электроны;
- пластичность и ковкость;
- характе́рный металлический блеск;
- высокая электропроводность;
- хорошая проводимость тепла;
- положительная степень окисления.
Неметаллы занимают правый верхний угол таблицы химических элементов. Для таких структур характерно принимать электроны, образуя ковалентную химическую связь. Среди неметаллов есть и газы, и жидкости, и твёрдые частицы. Они могут обладать как положительной, так и отрицательной степенью окисления. К этому классу относятся кислород (O₂), гелий (He₂), хлор (Cl₂), ксенон (Xe₂).
В большинстве случаев названия простых веществ совпадают с номенклатурой элементов в таблице. Исключение составляют лишь аллотропные соединения.
Самым простым примером является кислород. Один и тот же элемент может образовывать разные вещества: O₂ — обычный кислород, O₃ — озон.
Сложные соединения
Бо́льшая часть химических структур в природе имеет сложный состав. Иными словами, формула состоит из атомов нескольких простых элементов. В классификации сложных веществ принято выделять несколько групп соединений.
Характеристика и свойства оксидов
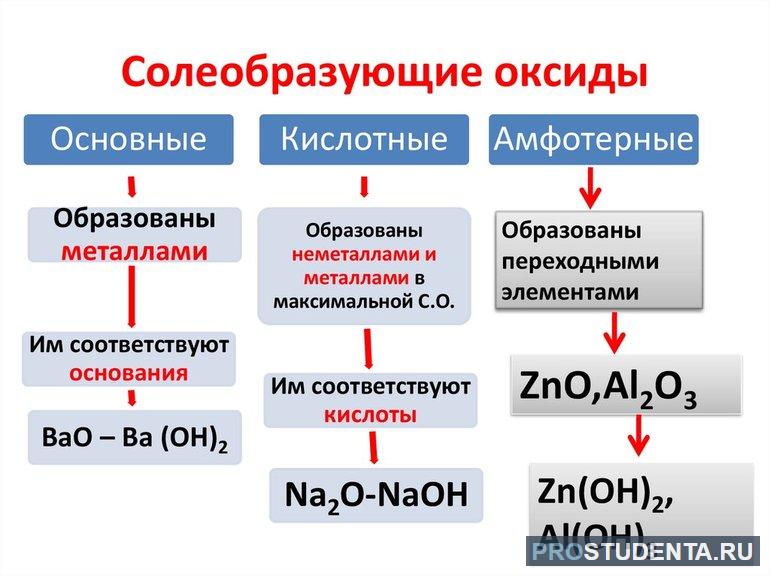
Соединение, состоящее из одного химического элемента и кислорода, называют оксидом. Вещество O₂ всегда находится в отрицательной степени окисления -2. Оксиды подразделяются на солеобразующие и безразличные.
Первая группа вступает в реакцию с кислотами и основаниями, образуя соли. Для второй группы подобные превращения нехарактерны. Солеобразующие оксиды бывают:
- основными (вступают в реакцию с кислотами);
- кислотными (взаимодействуют с основаниями);
- амфотерными (реагируют на оба вида соединений).
Несолеобразующих оксидов всего пять: CO, NO, N₂O, SiO, Н₂O.
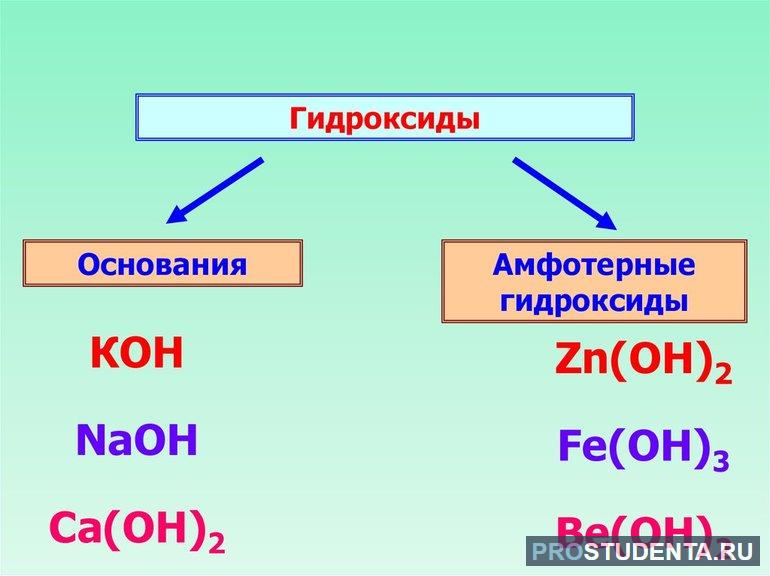
Виды гидроксидов
Соединения этой группы имеют общую формулу Э (OH)ₓ, где Э — химический элемент, (ОН)ₓ — одна или несколько гидроксильных групп. Сложные вещества подразделяются на 3 категории:
- основания;
- кислородсодержащие кислоты;
- амфотерные гидроксиды.
Основания — это химические структуры, состоящие из ионов металла и гидроксильной группы. Среди них выделяют щёлочи и нерастворимые соединения. В состав кислородсодержащих кислот входят неметаллы. Амфотерные основания характеризуются смешанными свойствами. Они могут играть роль и кислоты, и гидроксида. Свойство зависит только от того, какое вещество вступает в реакцию с основанием. Гидроксиды широко применяются в медицинской, машиностроительной и сельскохозяйственной промышленности.
Кислоты и соли
К важным классам неорганических веществ относятся кислоты — соединения, состоящие из катиона Н⁺ и кислотного остатка. Атом водорода, замещающийся на металл, имеет ключевое значение.
К самым распространённым кислотам, используемым в быту и промышленности, можно отнести HCl (соляную), H₂SO₄ (серную) и HNO₃ (азотную). С учетом количества ионов водорода в составе вещества кислоты подразделяются на несколько групп:
- односоставные (без катиона H⁺);
- двухосновные (с двумя атомами);
- трехосновные (с тремя H⁺).
Существуют и другие классификации кислот. Учитывая наличие или отсутствие O₂ в кислотном остатке, можно выделить бескислородные или кислородсодержащие соединения. По степени диссоциации вещества делятся на простые и сложные.
Соли — продукт реакции между кислотой и основанием. Это самый распространённый класс сложных соединений в химии. По общему правилу в состав солей входят катион металла и кислотная группа. Но точная формула зависит от исходных реагентов и принадлежности к той или иной группе. Принято выделять средние, кислые и основные соли.
Средние состоят из одного катиона металла и одной кислотной группы. К этому виду можно отнести соединения Na₂CO₃, CuCl. В состав кислых солей обязательно входит атом водорода: NaHCO₃, KH₂PO₄. Основные характеризуются наличием гидроксильной группы (OH) в формуле структуры (как в соединении CuOHCl). По количеству анионов и катионов в структуре соли делятся на простые, двойные и смешанные.
Соли используются в разных сферах деятельности в неограниченных количествах. Самым знаменитым представителем этого класса неорганических соединений является хлорид натрия NaCl. Поваренная соль применяется и в быту как основная приправа к блюдам, а также в медицине и сельском хозяйстве.




Ещё никто не комментировал эту статью. Оставьте комментарий первым!