Электронная конфигурация атомов и ионов
В химии есть очень увлекательный, но сложный раздел – электронная конфигурация атомов и ионов.
Оглавление:
Молекулу любого из элементов таблицы Менделеева можно изучить с точки зрения как физики, так и химии.
Дивный молекулярный мир на атомном уровне отличается от привычного. Разберем подробно, как образуется электронная формула элементов.
Строение «электронных» оболочек атомов
Для лучшего понимания электронных окружающих ядро оболочек, нужно знать об ионе – частице, в основе которой, кроме электронов, присутствуют так называемые протоны.

Если число протонов больше числа электронов, то такой атом называется катионом (положительный заряд). В противном случае атом называется анионом (заряд отрицательный).
Каждый из электронов занимает свой собственный уровень относительно ядра.

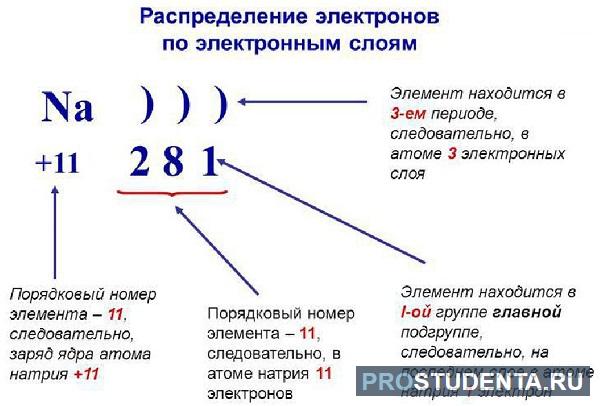
Конфигурация электронов для отдельно взятого атома может строиться в порядке атомных чисел. В качестве первоначального элемента выбирается водород, а далее продолжается добавление одного протона к ядру согласно с подсхемой и местом в периодической таблице, пока не опишутся все химические элементы.
Такая процедура называется принципом Aufbau (Ауфбау). Название принципа происходит от немецкого слова и переводится «построить».
Можно сделать вывод, что появление ионов связано с моментом, когда атомы получают или теряют заряды. Катион (положительно заряженный ион) образуется, когда один или несколько зарядов удаляются из «родительского атома».
Распределение электронных зарядов по уровням
Как уже говорилось выше, молекула любого элемента периодической таблицы – это своеобразный микрокосмос, где в разные стороны (спины) двигаются заряженные частицы (лептон). По-английски spin означает «вращение». Их полуцелые «спины» были описаны Вольфгангом Паули в 1925 году.

Всего принципов построения графических распределительных схем существует три:
- Принцип ограничений, который сформирован швейцарским физиком В. Паули. На одном электронном уровне ядра может быть два лептона с разным направлением вращения (если один вращается против часов стрелки, то другой - по часовой). Опыты в адронном коллайдере доказали этот факт.
- Второй строительный принцип говорит, что лептоны стремятся занять уровни по мере возрастания энергетического запаса.
- Третий гласит, что любой электрон «любит» только себя и плохо переносит «соседей» по орбитали. Иными словами, сначала электроны занимают свободные клетки (в графическом исполнении формулы), а уже по второму кругу занимают свободные места.
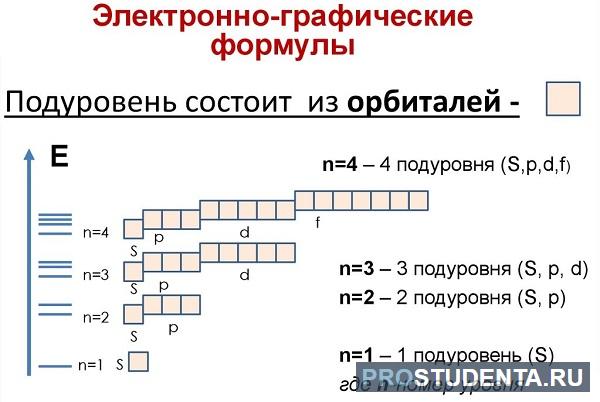
Теперь рассмотрим состав «квартир» для лептонов. В зависимости от уровня и энергии, орбитальные места можно разделить на четыре формы:
- Эс (s) имеет форму круга и способен на одном уровне вместить только два заряда ядра.
- Пи (p) готов предоставить три «места» для шести лептонов.
- Де (d) предоставляет пять «мест» – 10 заряженных частиц.
- Эф (f) самый щедрый на «места», их число равно семи – соответственно 14 парных частиц.
Электронные формулы химических элементов
Здесь приводится таблица-подсказка для некоторых химических элементов.
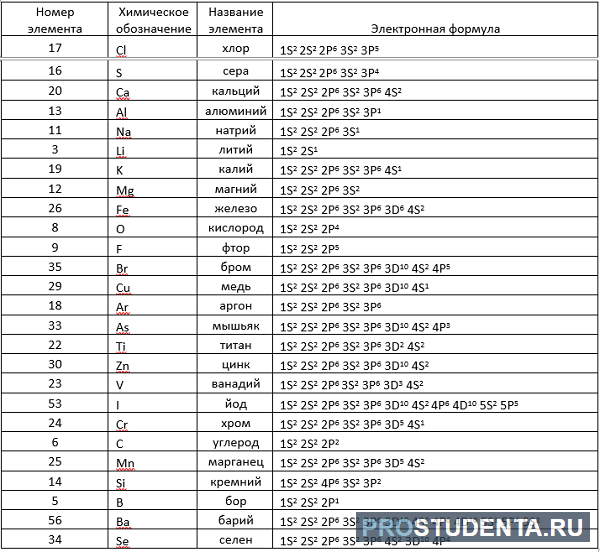
Теперь, руководствуясь данными таблицы, разберем электронные записи элементов на примере «аргона» (Ar).
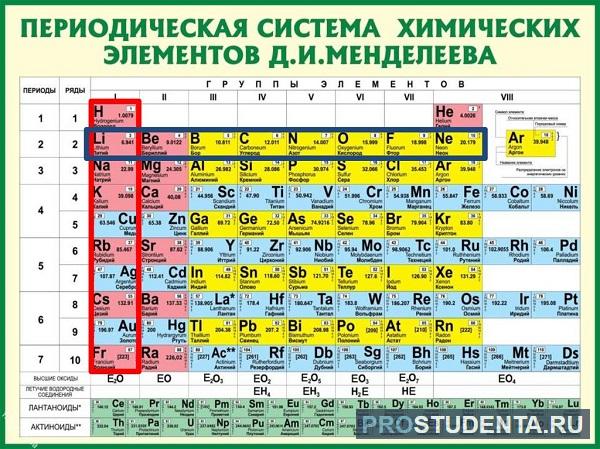
В таблице Менделеева его номер - восемнадцать. Руководствуясь описанным выше, высчитываем количество частиц (всего их 18).

Ещё до построения электронно-графической формулы Аргона, вспомним, как формируются орбитали и строятся ячейки:
Начинаем распределять электроны Ar:
- a) поскольку аргон находится в третьем периоде, то у него три подуровня. Смотрим в учебник химии и находим, что это p-элемент;
- b) запишем формулу: 1 s, 2 s, 2 p, 3 s, 3 p;
- c) теперь рисуем орбитальные ячейки и заполняем их.
[caption id="attachment_64060" align="aligncenter" width="204"]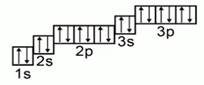 Графическое изображение формулы аргона[/caption]
Графическое изображение формулы аргона[/caption]

[advice]Важно знать: непарные заряды во внешних орбиталях, называемые валентными зарядами, отвечают за большинство химических и физических проявлений элементов.[/advice]
Заключение
Чтобы немного отстранится от научных теорий, стоит пофантазировать. Представьте атомное ядро и окружающие его заряды вселенной. Ядро – это солнце, а заряды - планеты. Формула наглядно описывает положение подобных «планет» в космосе (атомного вещества). Чтобы перейти с одного уровня на другой, потребуется большая энергия.
В квантовой физике некоторые специалисты выдвинули теорию о том, что при вмешательстве в структуру атома можно сделать объект невидимым. Ведь если подумать, то фотон (мельчайшая частица света) может не вступать в связь с электронами атома и, не встречая сопротивления, преодолевать объект.
Впечатляет? Химическая формула элемента очень важна для физики. Благодаря труду Менделееву и его таблице, нам стали доступны современные технологии. Химические формулы и эксперименты скучны и сложны, хочется верить, что эта статья сделала их более понятными.


Ещё никто не комментировал эту статью. Оставьте комментарий первым!